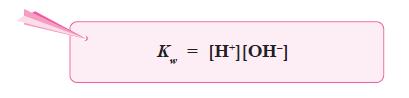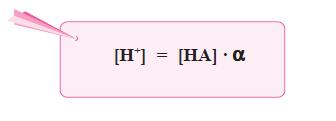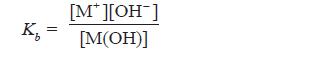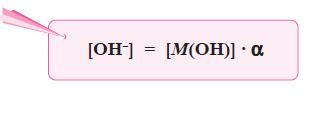Asam dan basa sudah dikenal sejak zaman dulu. Istilah asam (acid)
berasal dari bahasa Latin acetum yang berarti cuka. Istilah basa
(alkali) berasal dari bahasa Arab yang berarti abu. Basa digunakan dalam
pembuatan sabun. Juga sudah lama diketahui bahwa asam dan basa saling
menetralkan. Di alam, asam ditemukan dalam buah-buahan, misalnya asam
sitrat dalam buah jeruk berfungsi untuk memberi rasa limun yang tajam.
Cuka mengandung asam asetat, dan asam tanak dari kulit pohon digunakan
untuk menyamak kulit. Asam mineral yang lebih kuat telah dibuat sejak
abad pertengahan, salah satunya adalah aqua forti (asam nitrat) yang
digunakan oleh para peneliti untuk memisahkan emas dan perak.

Pada tahun 1884, Svante Arrhenius (1859-1897) seorang ilmuwan Swedia
yang memenangkan hadiah nobel atas karyanya di bidang ionisasi,
memperkenalkan pemikiran tentang senyawa yang terpisah atau terurai
menjadi bagian ion-ion dalam larutan. Dia menjelaskan bagaimana kekuatan
asam dalam larutan aqua (air) tergantung pada konsentrai ion-ion
hidrogen di dalamnya.
Menurut Arrhenius,
asam adalah zat yang dalam air melepakan ion H+, sedangkan
basa adalah zat yang dalam air melepaskan ion OH–. Jadi pembawa sifat asam adalah ion
H+, sedangkan pembawa sifat basa adalah ion
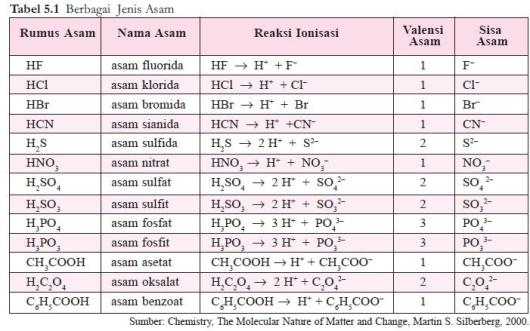
OH–. Asam Arrhenius dirumuskan sebagai HxZ, yang dalam air mengalami ionisasi sebagai berikut.
HxZ ⎯⎯→ x H+ + Zx–
Jumlah ion H+ yang dapat dihasilkan oleh 1 molekul asam disebut
valensi asam, sedangkan ion negatif yang terbentuk dari asam setelah melepaskan ion H+ disebut
ion sisa asam. Beberapa contoh asam dapat dilihat pada tabel 5.1.
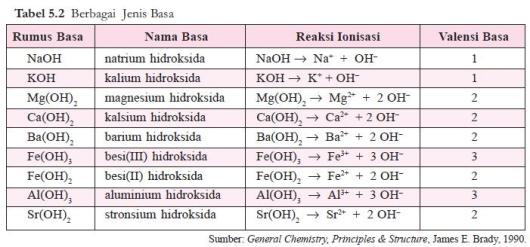
Basa Arrhenius adalah hidroksida logam, M(OH)x, yang dalam air terurai sebagai berikut.
M(OH)x ⎯⎯→ Mx+ + x OH–
Jumlah ion OH– yang dapat dilepaskan oleh satu molekul basa disebut
valensi basa. Beberapa contoh basa diberikan pada tabel 5.2.
Asam sulfat dan magnesium hidroksida dalam air mengion sebagai berikut.
H2SO4 ⎯⎯→ 2 H+ + SO42–
Mg(OH)2 ⎯⎯→ Mg+ + 2 OH–
 Persamaan ionisasi air dapat ditulis sebagai:
Persamaan ionisasi air dapat ditulis sebagai:
H2O(l) ←⎯⎯⎯⎯→ H+(aq) + OH–(aq)
- Harga tetapan air adalah:

- Konsentrasi H2O yang terionisasi menjadi H+ dan OH– sangat kecil
dibandingkan dengan konsentrasi H2O mula-mula, sehingga konsentrasi H2O
dapat dianggap tetap, maka harga K[H2O] juga tetap, yang disebut tetapan
kesetimbangan air atau ditulis Kw.
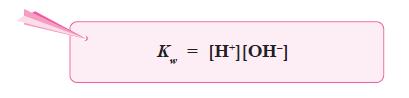
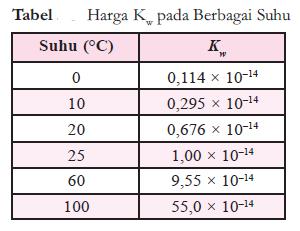
- Pada suhu 25 °C, Kw yang didapat dari percobaan adalah 1,0 × 10–14.
- Harga Kw ini tergantung pada suhu, tetapi untuk percobaan yang
suhunya tidak terlalu menyimpang jauh dari 25 °C, harga Kw itu dapat
dianggap tetap.
- Harga Kw pada berbagai suhu dapat dilihat pada tabel berikut.



Kekuatan asam dipengaruhi oleh banyaknya ion – ion H+ yang dihasilkan
oleh senyawa asam dalam larutannya. Berdasarkan banyak sedikitnya ion H+
yang dihasilkan, larutan asam dibedakan menjadi dua macam sebagai berikut.
1. Asam Kuat
Asam kuat yaitu senyawa asam yang dalam larutannya terion seluruhnya
menjadi ion-ionnya. Reaksi ionisasi asam kuat merupakan reaksi
berkesudahan. Secara umum, ionisasi asam kuat dirumuskan sebagai berikut.
HA(aq) ⎯⎯→ H+(aq) + A–(aq)

2. Asam Lemah
Asam lemah yaitu senyawa asam yang dalam larutannya hanya sedikit
terionisasi menjadi ion-ionnya. Reaksi ionisasi asam lemah merupakan reaksi
kesetimbangan.
Secara umum, ionisasi asam lemah valensi satu dapat dirumuskan
sebagai berikut.
HA(aq) ←⎯⎯⎯⎯→ H+(aq) + A–(aq)
Makin kuat asam maka reaksi kesetimbangan asam makin condong ke
kanan, akibatnya Ka bertambah besar. Oleh karena itu, harga Ka merupakan
ukuran kekuatan asam, makin besar Ka makin kuat asam.
Berdasarkan persamaan di atas, karena pada asam lemah [H+] = [A–],
maka persamaan di atas dapat diubah menjadi:

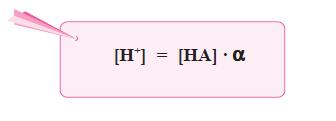


- Kekuatan basa dipengaruhi oleh banyaknya ion – ion OH– yang dihasilkan oleh senyawa basa dalam larutannya.
- Berdasarkan banyak sedikitnya ion OH yang dihasilkan, larutan basa juga dibedakan menjadi dua macam sebagai berikut.
1. Basa Kuat
- Basa kuat yaitu senyawa basa yang dalam larutannya terion seluruhnya
menjadi ion-ionnya. Reaksi ionisasi basa kuat merupakan reaksi
berkesudahan.
- Secara umum, ionisasi basa kuat dirumuskan sebagai berikut.
M(OH)x(aq) ⎯⎯→ Mx+(aq) + x OH–(aq)
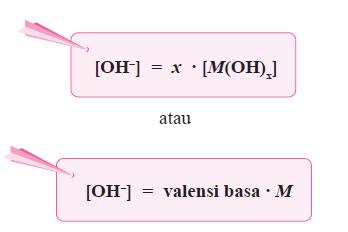
dengan: x = valensi basa
M = konsentrasi basa
2. Basa Lemah
- Basa lemah yaitu senyawa basa yang dalam larutannya hanya sedikit terionisasi menjadi ion-ionnya.
- Reaksi ionisasi basa lemah juga merupakan reaksi kesetimbangan.
- Secara umum, ionisasi basa lemah valensi satu dapat dirumuskan sebagai berikut.
M(OH)(aq) ←⎯⎯⎯⎯→ M+(aq) + OH–(aq)
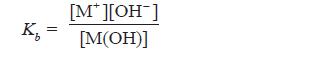
- Makin kuat basa maka reaksi kesetimbangan basa makin condong ke kanan, akibatnya Kb bertambah besar.
- Oleh karena itu, harga Kb merupakan ukuran kekuatan basa, makin besar Kb makin kuat basa.
- Berdasarkan persamaan di atas, karena pada basa lemah [M+] = [OH–], maka persamaan di atas dapat diubah menjadi:

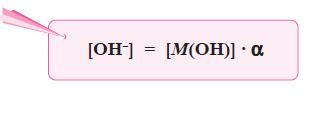


- Untuk menyatakan tingkat atau derajat keasaman suatu larutan, pada
tahun 1910, seorang ahli dari Denmark, Soren Lautiz Sorensen
memperkenalkan suatu bilangan yang sederhana.
- Bilangan ini diperoleh dari hasil logaritma konsentrasi H+.
- Bilangan ini kita kenal dengan skala pH. Harga pH berkisar antara 1 – 14 dan ditulis:

- Dari uraian di atas dapat kita simpulkan bahwa:
a. Larutan bersifat netral jika [H+] = [OH–] atau pH = pOH = 7.
b. Larutan bersifat asam jika [H+] > [OH–] atau pH < 7.
c. Larutan bersifat basa jika [H+] < [OH–] atau pH > 7.
- Karena pH dan konsentrasi ion H+ dihubungkan dengan tanda negatif,
maka makin besar konsentrasi ion H+ makin kecil pH, dan karena bilangan
dasar logaritma adalah 10, maka larutan yang nilai pH-nya berbeda
sebesar n mempunyai perbedaan ion H+ sebesar 10n.
- Perhatikan contoh di bawah ini.
- Jika konsentrasi ion H+ = 0,01 M, maka pH = – log 0,01 = 2
- Jika konsentrasi ion H+ = 0,001 M (10 kali lebih kecil) maka pH = – log 0,001 = 3 (naik 1 satuan)
- Jadi dapat disimpulkan:
• Makin besar konsentrasi ion H+ makin kecil pH
• Larutan dengan pH = 1 adalah 10 kali lebih asam daripada larutan dengan pH = 2.

- Untuk menentukan pH suatu larutan dapat dilakukan dengan beberapa cara, antara lain sebagai berikut.
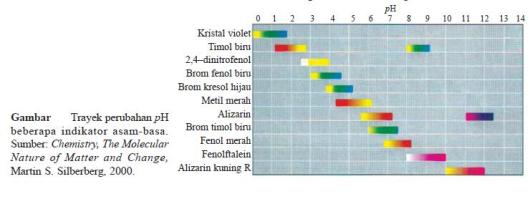
1. Menggunakan Beberapa Indikator
- Indikator adalah asam organik lemah atau basa organik lemah yang
dapat berubah warna pada rentang harga pH tertentu (James E. Brady,
1990).
- Harga pH suatu larutan dapat diperkirakan dengan menggunakan trayek pH indikator.
- Indikator memiliki trayek perubahan warna yang berbeda-beda.
- Dengan demikian dari uji larutan dengan beberapa indikator akan diperoleh daerah irisan pH larutan.
- Contoh, suatu larutan dengan brom timol biru (6,0– 7,6) berwarna
biru dan dengan fenolftalein (8,3–10,0) tidak berwarna, maka pH larutan
itu adalah 7,6–8,3.
- Hal ini disebabkan jika brom timol biru berwarna biru, berarti pH
larutan lebih besar dari 7,6 dan jika dengan fenolftalein tidak
berwarna, berarti pH larutan kurang dari 8,3.

Konsep Asam-Basa Bronsted dan Lowry
- Menurut Bronsted dan Lowry, asam adalah spesi yang memberi proton,
sedangkan basa adalah spesi yang menerima proton pada suatu reaksi
pemindahan proton.

- Perhatikan contoh berikut.
NH
4 + (aq) + H
2O
(l) ⎯→ NH
3(aq) + H
3O
+(aq)
asam basa
H
2O
(l) + NH
3(aq) ⎯⎯→ NH
4+(aq) + OH
–(aq)
asam basa
- Pada contoh di atas terlihat bahwa air dapat bersifat sebagai asam (donor proton) dan sebagai basa (akseptor proton).
- Zat seperti itu bersifat amfiprotik (amfoter).
- Konsep asam-basa dari Bronsted-Lowry ini lebih luas daripada konsep asam-basa Arrhenius karena hal-hal berikut :
- Konsep asam-basa Bronsted-Lowry tidak terbatas dalam pelarut air,
tetapi juga menjelaskan reaksi asam-basa dalam pelarut lain atau bahkan
reaksi tanpa pelarut.
- Asam-basa Bronsted-Lowry tidak hanya berupa molekul, tetapi juga
dapat berupa kation atau anion. Konsep asam-basa ronsted-Lowry dapat
menjelaskan sifat asam dari NH4Cl. Dalam NH4Cl, yang bersifat asam
adalah ion NH4+ karena dalam air dapat melepas proton.
Asam dan Basa Konjugasi
- Suatu asam setelah melepas satu proton akan membentuk spesi yang disebut basa konjugasi dari asam tersebut.
- Sedangkan basa yang telah menerima proton menjadi asam konjugasi.
- Perhatikan tabel berikut.

- Pasangan asam-basa setelah terjadi serah-terima proton dinamakan asam-basa konjugasi.

Konsep Asam-Basa LEWIS
Asam menurut Lewis adalah zat yang dapat menerima pasangan electron (akseptor pasangan electron)
Basa menurut Lewis adalah zat yang dapat memberikan pasangan electron (donor pasangan electron).
Lewis mengamati bahwa molekul BF
3 juga dapat berperilaku seperti halnya asam (H+) sewaktu bereaksi dengan NH
3. Molekul BF
3 dapat menerima sepasang elektron dari molekul NH
3 untuk membentuk ikatan kovalen antara B dan H.
Teori asam basa Lewis lebih luas dibandingkan Arhenius dan Bronsted Lowry , karena :
- Teori Lewis dapat menjelaskan reaksi asam basa yang berlangsung
dalam pelarut air, pelarut bukan air, dan tanpa pelarut sama sekali.
- Teori Lewis dapat menjelaskan reaksi asam basa yang tidak melibatkan transfer proton (H+), seperti reaksi antara BF3 dan NH3.
Contoh :
Tunjukkan bagaimana reaksi asam basa antara larutan HCl dan NaOH
menurut teori Arhenius dapat dijelaskan dengan menggunakan teori Lewis
Reaksi antara larutan HCl dan NaOH ;
HCl
(aq) + NaOH
(aq) ↔ NaCl
(aq) + H
2O
(l)
Untuk menjelaskan reaksi ini menggunakan teori Lewis, nyatakan reaksi sebagai reaksi ion:
HCl ↔ H
+ + Cl
- NaOH ↔ Na
+ + OH
-
NaCl ↔ Na
+ + Cl
- H
2O
Reaksi ion bersihnya adalah :
H
+ + OH
-↔ H
2O
(l)
Ikatan kovalen koordinasi antara H dan O yang terbentuk akibat transfer sepasang elektron dari OH
- ke H
+
LARUTAN PENYANGGA
== == Komponen Larutan Penyangga
Secara umum, larutan penyangga digambarkan sebagai campuran yang terdiri dari:
- Asam lemah (HA) dan basa konjugasinya (ion A-), campuran ini menghasilkan larutan bersifat asam.
- Basa lemah (B) dan asam konjugasinya (BH+), campuran ini menghasilkan larutan bersifat basa.
Komponen larutan penyangga terbagi menjadi:
- Larutan penyangga yang bersifat asam
Larutan ini mempertahankan pH pada daerah asam (pH < 7). Untuk
mendapatkan larutan ini dapat dibuat dari asam lemah dan garamnya yang
merupakan basa konjugasi dari asamnya. Adapun cara lainnya yaitu
mencampurkan suatu asam lemah dengan suatu basa kuat dimana asam
lemahnya dicampurkan dalam jumlah berlebih. Campuran akan menghasilkan
garam yang mengandung basa konjugasi dari asam lemah yang bersangkutan.
Pada umumnya basa kuat yang digunakan seperti natriumNa), kalium,
barium, kalsium, dan lain-lain.
- Larutan penyangga yang bersifat basa
Larutan ini mempertahankan pH pada daerah basa (pH > 7). Untuk
mendapatkan larutan ini dapat dibuat dari basa lemah dan garam, yang
garamnya berasal dari asam kuat. Adapun cara lainnya yaitu dengan
mencampurkan suatu basa lemah dengan suatu asam kuat dimana basa
lemahnya dicampurkan berlebih. ====
Cara kerja larutan penyangga
Larutan penyangga mengandung komponen asam dan basa dengan asam dan
basa konjugasinya, sehingga dapat mengikatbaik ion H+ maupun ion OH-.
Sehingga penambahan sedikit asam kuat atau basa kuat tidak mengubah
pH-nya secara signifikan. Berikut ini cara kerja larutan penyangga:
Larutan penyangga asam
Adapun cara kerjanya dapat dilihat pada larutan penyangga yang
mengandung CH3COOH dan CH3COO- yang mengalami kesetimbangan. Dengan
proses sebagai berikut:
Penambahan asam (H+) akan menggeser kesetimbangan ke kiri. Dimana ion
H+ yang ditambahkan akan bereaksi dengan ion CH3COO- membentuk molekul
CH3COOH.
CH3COO-(aq) + H+(aq) → CH3COOH(aq)
Jika yang ditambahkan adalah suatu basa, maka ion OH- dari basa itu
akan bereaksi dengan ion H+ membentuk air. Hal ini akan menyebabkan
kesetimbangan bergeser ke kanan sehingga konsentrasi ion H+ dapat
dipertahankan. Jadi, penambahan basa menyebabkan berkurangnya komponen
asam (CH3COOH), bukan ion H+. Basa yang ditambahkan tersebut bereaksi
dengan asam CH3COOH membentuk ion CH3COO- dan air.
CH3COOH(aq) + OH-(aq) → CH3COO-(aq) + H2O(l)
Larutan penyangga basa
Adapun cara kerjanya dapat dilihat pada larutan penyangga yang
mengandung NH3 dan NH4+ yang mengalami kesetimbangan. Dengan proses
sebagai berikut:
Jika ditambahkan suatu asam, maka ion H+ dari asam akan mengikat ion
OH-. Hal tersebut menyebabkan kesetimbangan bergeser ke kanan, sehingga
konsentrasi ion OH- dapat dipertahankan. Disamping itu penambahan ini
menyebabkan berkurangnya komponen basa (NH3), bukannya ion OH-. Asam
yang ditambahkan bereaksi dengan basa NH3 membentuk ion NH4+.
NH3 (aq) + H+(aq) → NH4+ (aq)
Jika yang ditambahkan adalah suatu basa, maka kesetimbangan bergeser
ke kiri, sehingga konsentrasi ion OH- dapat dipertahankan. Basa yang
ditambahkan itu bereaksi dengan komponen asam (NH4+), membentuk komponen
basa (NH3) dan air.
NH4+ (aq) + OH-(aq) → NH3 (aq) + H2O(l)
Perhitungan pH Larutan Penyangga
Larutan penyangga asam
Dapat digunakan tetapan ionisasi dalam menentukan konsentrasi ion H+ dalam suatu larutan dengan rumus berikut:
[H+] = Ka x a/valxgataupH = p Ka – log a/g
dengan, Ka = tetapan ionisasi asam lemah
-
- a = jumlah mol asam lemah
- g = jumlah mol basa konjugasi
Larutan penyangga basa
Dapat digunakan tetapan ionisasi dalam menentukan konsentrasi ion H+ dalam suatu larutan dengan rumus berikut:
[OH-] = Kb x b/valxgataupH = p Kb – log b/g
dengan, Kb = tetapan ionisasi basa lemah
-
- b = jumlah mol basa lemah
- g = jumlah mol asam konjugasi
Fungsi Larutan Penyangga
Adanya larutan penyangga ini dapat kita lihat dalam kehidupan
sehari-hari seperti pada obat-obatan, fotografi, industri kulit dan zat
warna. Selain aplikasi tersebut, terdapat fungsi penerapan konsep
larutan penyangga ini dalam tubuh manusia seperti pada cairan tubuh.
Cairan tubuh ini bisa dalam cairan intrasel maupun cairan ekstrasel.
Dimana sistem penyangga utama dalam cairan intraselnya seperti H2PO4-
dan HPO42- yang dapat bereaksi dengan suatu asam dan basa. Adapun sistem
penyangga tersebut, dapat menjaga pH darah yang hampir konstan yaitu
sekitar 7,4. Selain itu penerapan larutan penyangga ini dapat kita temui
dalam kehidupan sehari-hari seperti pada obat tetes mata. Pada obat
tetes mata mempunyai pH yang sama dengan cairan tubuh kita, agar tidak
menimbulkan efek samping.
idrolisis Garam dalam Kehidupan Sehari-Hari
Agar tanaman tumbuh dengan baik, maka pH tanaman harus dijagam pH
tanah di daerah pertanian harus disesuaikan dengan pH tanamannya. Oleh
karena itu diperlukan pupuk yang dapat menjaga pH tanah agar tidak
terlalu asam atau basa. Biasanya para petani menggunakan pelet padat (NH 4 ) 2 SO 4 untuk menurunkan pH tanah. Garam (NH 4 ) 2 SO 4 bersifat asam, ion NH 4 + akan terhidrolisis dalam tanah membentuk NH 3 dan H + yang bersifat asam.
Kita juga sering memakai bayclin atau sunklin untuk memutihkan
pakaian kita. Produk ini mengandung kira-kira 5 % NaOCl yang sangat
reaktif sehingga dapat menghancurkan pewarna, sehingga pakaian menjadi
putih kembali. Garam ini terbentuk dari asam lemah HOCl dengan basa kuat
NaOH. Ion OCl - terhidrolisis menjadi HOCl dan OH -, sehingga garam NaOCl bersifat basa.
HIDROLISIS GARAM
Garam yang mengalami hidrolisis membentuk suatu reaksi kesetimbangan.
Pada reaksi kesetimbangan anion basa atau kation asam, akan dibebaskan
OH
- atau H
+ . Ion OH
- dan ion H
+
inilah yang dapat menentukan apakah larutan tersebut bersifat asam,
basa atau netral. Karena hidrolisis garam merupakan reaksi refersibel
(bolak-balik), maka reaksi ini mempunyai tetapan kesetimbangan yang
disebut tetapan hidrolisis (Kh). Besarnya Kh bergantung pada harga
tetapan ionisasi asam (Ka) atau tetapan ionisasi basa (Kb). Tetapan
hidrolisis dapat digunakan untuk menentukan pH larutan garam.
1. Garam dari Asam Kuat dengan Basa Kuat
Garam yang berasal dari asam kuat dan basa kuat jika dilarutkan dalam
air menunjukkan reaksi netral, karena anion maupun kationnya
masing-masing tidak ada yang bergabung dengan ion hidrogen atau
hidroksida. Untuk menentukan produk yang sangat sedikit berdisosiasi.
Karena itu kesetimbangan air tidak terganggu.
H
2 O
(l) → H
+ (aq) + OH
- (aq)
Karena konsetrasi H
+ dan OH
- dalam larutan sama, maka larutan bersifat netral (pH=7)
2. Garam dari Asam Kuat dengan Basa Lemah
Jika garam yang berasal dari asam kuat dengan basa lemah dilarutkan
ke dalam air, maka larutan tersebut bersifat asam (pH < 7). Kation
asam (BH
+ ) dari garam bereaksi dengan air yang menghasilkan ion H
3 O
+ .
BH
+ (aq) + H
2 O
(l) → B
(aq) + H
3 O
+ (aq) .
Reaksi ini mempunyai tetapan hidrolisis (Kh) sebagai berikut.
Konsentrasi BH
+ semula, sama dengan konsentrasi garamnya. Jika konsentrasi BH
+ mula-mula sebesar M dan hidrolisis sebesar α, maka konsentrasi semua komponen dalam persamaan tersebut adalah:

Karena nilai α sangat kecil, maka besarnya α pada M-α diabaikan, sehingga untuk M-α = M. Besarnya konsentrasi B dan H
3 O
+ adalah sama. Karena H
3 O
+ dapat diganti H
+, persamaan tetapan hidrolisis dapat ditulis.

Suatu basa dapat mengalami kesetimbangan sebagai berikut.
B
(aq) + H
2 O
(l) → BH
+ (aq) + OH
- (l)
Selanjutnya konsentrasi ion H
+ dapat ditulis:

Keterangan:
Kh : tetapan hidrolisis
Kw : tetapan kesetimbangan air
Kb : tetapan ionisasi basa
[BH
+ ] : konsentrasi kation dari garam
3. Garam dari Asam Lemah dengan Basa Kuat
Garam yang berasal dari asam lemah dengan basa kuat jika dilarutkan
dalam air maka larutan tersebut bersifat basa (pH > 7). Anion basa (A
- ) dari garam bereaksi dalam air yang menghasilkan ion OH
- .
A
- (aq) + H
2 O
(l) → HA
(aq) + OH
- (aq)
Reaksi ini mempunyai tetapan hidrolisis sebagai berikut.

Konsentrasi A
- semula sama dengan konsentrasi garamnya. Jika konsentrasi A
- mula-mula sebesar M dan terhidrolisis sebesar α, maka untuk konsentrasi semua komponen dalam persamaan tersebut adalah:
Karena nilai α relatif kecil (dapat diabaikan) sehingga nilai (M-α) sama dengan M.
Asam lemah akan terionisasi menjadi:
HA → H
+ + A
-
Konsentrasi HA sama dengan konsentrasi OH
-, sehingga diperoleh persamaan tetapan:


Selanjutnya konsentrasi OH
- dapat dihitung dengan rumus:

Keterangan:
Kh : tetapan hidrolisis
Kw : tetapan kesetimbangan air
Ka : tetapan ionisasi asam
[A-] : konsentrasi anion dari garam
4. Garam dari Asam Lemah dan Basa Lemah
Garam yang berasal dari asam lemah dan basa lemah jika dilarutkan
dalam air dapat bersifat asam, basa atau netral tergantung pada kekuatan
relatif asam dan basa penyusunnya. Larutan garam ini akan terhidrolisis
sempurna baik kation [BH
+ ] maupun anionnya [A
- ].
Tetapan hidrolisis (Kh) dari hidrolisis di atas dapat ditulis sebagai berikut.



Selanjutnya untuk menghitung [H
+ ] adalah sebagai berikut.


Keterangan:
Kh : tetapan hidrolisis
Kw : tetapan kesetimbangan air
Ka : tetapan ionisasi asam
Kb : tetapan ionisasi basa
Konsep Hidrolisis Garam
Pencampuran larutan asam dengan larutan basa akan menghasilkan garam
dan air. Namun demikian, garam dapat bersifat asam, basa maupun netral.
Sifat garam bergantung pada jenis komponen asam dan basanya. Garam dapat
terbentuk dari asam kuat dengan basa kuat, asam lemah dengan basa kuat,
asam kuat dengan basa lemah, atau asam lemah dengan basa lemah. Jadi,
sifat asam basa suatu garam dapat ditentukan dari kekuatan asam dan basa
penyusunnya. Sifat keasaman atau kebasaan garam ini disebabkan oleh
sebagian garam yang larut bereaksi dengan air. Proses larutnya sebagian
garam bereaksi dengan air ini disebut
hidrolisis (hidro yang berarti air dan lisis yang berarti peruraian).
1. Garam dari Asam Kuat dengan Basa Kuat
Asam kuat dan basa kuat bereaksi membentuk garam dan air. Kation dan
anion garam berasal dari elektrolit kuat yang tidak terhidrolisis,
sehingga larutan ini bersifat netral, pH larutan ini sama dengan 7.
Contoh
Larutan KCl berasal dari basa kuat KOH terionisasi sempurna membentuk kation dan anionnya. KOH terionisasi menjadi H
+ dan Cl
- . Masing-masing ion tidak bereaksi dengan air, reaksinya dapat ditulis sebagai berikut.
KCl
(aq) → K
+ (aq) + Cl
- (aq)

K
+ (aq) + H
2 O
(l) →

Cl
- (aq) + H
2 O
(l) →
2. Garam dari Asam Kuat dengan Basa Lemah
Garam yang terbentuk dari asam kuat dengan basa lemah mengalami
hidrolisis sebagian (parsial) dalam air. Garam ini mengandung kation
asam yang mengalami hidrolisis. Larutan garam ini bersifat asam, pH
<7.
Contoh
Amonium klorida (NH
4 Cl) merupakan garam yang terbentuk dari asam kuat, HCl dalam basa lemah NH
3 . HCl akan terionisasi sempurna menjadi H
+ dan Cl
- sedangkan NH
3 dalam larutannya akan terionisasi sebagian membentuk NH
4 + dan OH
- . Anion Cl
- berasal dari asam kuat tidak dapat terhidrolisis, sedangkan kation NH
4 + berasal dari basa lemah dapat terhidrolisis.
NH
4 Cl
(aq) → NH
4 + (aq) + Cl
- (aq)

Cl
- (aq) + H
2 O
(l) →
NH
4 + (aq) + H
2 O
(l) → NH
3 (aq) + H
3 O
+ (aq)
Reaksi hidrolisis dari amonium (NH
4 + ) merupakan reaksi kesetimbangan. Reaksi ini menghasilkan ion oksonium (H
3 O
+ ) yang bersifat asam (pH<7). Secara umum reaksi ditulis:
BH
+ + H
2 O → B + H
3 O
+
3. Garam dari Asam Lemah dengan Basa Kuat
Garam yang terbentuk dari asam lemah dengan basa kuat mengalami
hidrolisis parsial dalam air. Garam ini mengandung anion basa yang
mengalami hidrolisis. Larutan garam ini bersifat basa (pH > 7).
Contoh
Natrium asetat (CH
3 COONa) terbentuk dari asam lemah CH
3 COOH dan basa kuat NaOH. CH
3 COOH akan terionisasi sebagian membentuk CH
3 COO
- dan Na
+ . Anion CH
3 COO
- berasal dari asam lemah yang dapat terhidrolisis, sedangkan kation Na
+ berasal dari basa kuat yang tidak dapat terhidrolisis.
CH
3 COONa
(aq) → CH
3 COO
- (aq) + Na
+ (aq)

Na
+ (aq) + H
2 O
(l) →
CH
3 COO
- (aq) + H
2 O
(l) → CH
3 COOH
(aq) + OH
- (aq)
Reaksi hidrolisis asetat (CH
3 COO
‑ ) merupakan reaksi kesetimbangannya. Reaksi ini menghasilkan ion OH
‑ yang bersifat basa (pH > 7). Secara umum reaksinya ditulis:
A
- + H
2 O → HA + OH
-
4. Garam dari Asam Lemah dengan Basa Lemah
Asam lemah dengan basa lemah dapat membentuk garam yang terhidrolisis
total (sempurna) dalam air. Baik kation maupun anion dapat
terhidrolisis dalam air. Larutan garam ini dapat bersifat asam, basa,
maupun netral. Hal ini bergantung dari perbandingan kekuatan kation
terhadap anion dalam reaksi dengan air.
Contoh
Suatu asam lemah HCN dicampur dengan basa lemah, NH
3 akan terbentuk garam NH
4 CN. HCN terionisasi sebagian dalam air membentuk H
+ dan CN
- sedangkan NH
3 dalam air terionisasi sebagian membentuk NH4+ dan OH-. Anion basa CN
- dan kation asam NH
4 + dapat terhidrolisis di dalam air.
NH
4 CN
(aq) → NH
4 + (aq) + CN
- (aq)
NH
4 + (aq) + H
2 O → NH
3(aq) + H
3 O
(aq) +
CN
- (aq) + H
2 O
(e) → HCN
(aq) + OH
- (aq)
Sifat larutan bergantung pada kekuatan relatif asam dan basa penyusunnya (Ka dan Kb)
- Jika Ka < Kb (asam lebih lemah dari pada basa) maka anion akan terhidrolisis lebih banyak dan larutan bersifat basa.
- jika Ka > Kb (asam lebih kuat dari pada basa) maka kation akan terhidrolisis lebih banyak dalam larutan bersifat asam.
- Jika Ka = Kb (asam sama lemahnya dengan basa) maka larutan bersifat netral.
KELARUTAN DAN HASIL KELARUTAN
Apabila suatu zat kita larutkan ke dalam suatu pelarut, ternyata ada yang
mudah larut (kelarutannya besar), ada yang
sukar larut (kelarutannya kecil), dan ada yang
tidak larut
(kelarutannya dianggap nol). Sebenarnya, tidak ada zat yang tidak larut
dalam pelarut. Misalnya, dalam pelarut air semua zat (termasuk logam)
dapat larut, hanya saja kelarutannya sangat kecil. Jika suatu zat
terlarut dalam pelarut sangat sedikit, misalnya kurang dan 0,1 gram zat
terlarut dalam 1.000 gram pelarut, maka zat tersebut kita katakan tidak
larut
(insoluble). Di sini, kita akan membicarakan zat padat yang sedikit kelarutannya dalam air.
Jika suatu zat padat, contohnya padatan PbI
2, kita larutkan ke dalam air maka molekul-molekul padatan PbI
2 akan terurai, selanjutnya melarut dalam air. Untuk melarutkan PbI
2 ke dalam air akan ada dua proses yang berlawanan arah (proses bolak-balik), yaitu proses pelarutan padatan PbI
2 dan proses pembentukan ulang padatan PbI
2 . Mula-mula, laju pelarutan padatan PbI
2 sangat cepat dibandingkan dengan laju pembentukan ulang padatan tersebut. Makin lama, konsentrasi PbI
2 yang terlarut meningkat dengan teratur dan laju pembentukan ulang padatan juga meningkat. Pada saat laju pelarutan padatan PbI
2 sama dengan pembentukan ulang padatan, proses yang saling berlawanan arah tersebut kita katakan berada dalam
kondisi kesetimbangan .
Pada kondisi kesetimbangan ini, larutan PbI
2 pada kondisi tepat jenuh. Jumlah PbI
2 yang dapat larut sampai dengan tercapainya kondisi tepat jenuh dinamakan
kelarutan PbI
2
. Secara umum, pengertian kelarutan suatu zat dalam air adalah batas
maksimum dari jumlah suatu zat yang dapat larut dalam sejumlah tertentu
air.
PbI
2 melarut dalam air dalam bentuk ion Pb
2+ dan 2 ion I
-, sehingga proses kesetimbangan PbI
2 dalam air merupakan kesetimbangan ionisasi PbI
2 dalam air, yaitu sebagai berikut.
PbI 2 (s) –> Pb 2+ (aq) + 2 I - (aq)
Dalam larutan PbI
2 jenuh terdapat reaksi ionisasi PbI
2 dalam keadaan setimbang. Tetapan kesetimbangan ini kita namakan tetapan hasil kali kelarutan
(solubility product constant) dan disimbolkan dengan
K sp .
Persamaan tetapan kesetimbangan PbI
2 :

Persamaan tetapan hasil kali kelarutan
(Ksp) adalah sebagai berikut.
Dari persamaan
K sp di atas dapat kita nyatakan pula bahwa nilai dari
K sp merupakan perkalian dari ion-ion yang melarut dipangkatkan dengan koefisien masing-masing.
Besarnya nilai hasil kali kelarutan mencerminkan mudah atau tidaknya larutan elektrolit larut dalam air.
Sistem koloid
Dari Wikipedia bahasa Indonesia, ensiklopedia bebas
Sistem koloid (selanjutnya disingkat “koloid” saja) merupakan suatu bentuk campuran (
sistem dispersi) dua atau lebih zat yang bersifat homogen namun memiliki ukuran partikel terdispersi yang cukup besar (
1 – 100 nm), sehingga terkena
efek Tyndall. Bersifat homogen berarti partikel terdispersi tidak terpengaruh oleh
gaya gravitasi atau gaya lain yang dikenakan kepadanya; sehingga tidak terjadi pengendapan, misalnya. Sifat homogen ini juga dimiliki oleh
larutan, namun tidak dimiliki oleh campuran biasa (
suspensi).
Koloid mudah dijumpai di mana-mana:
susu,
agar-agar,
tinta,
sampo, serta
awan merupakan contoh-contoh koloid yang dapat dijumpai sehari-hari.
Sitoplasma dalam
sel juga merupakan sistem koloid.
Kimia koloid menjadi kajian tersendiri dalam
kimia industri karena kepentingannya.
Macam-macam koloid
Koloid memiliki bentuk bermacam-macam, tergantung dari
fase zat pendispersi dan zat terdispersinya. Beberapa jenis koloid:
- Aerosol
yang memiliki zat pendispersi berupa gas. Aerosol yang memiliki zat
terdispersi cair disebut aerosol cair (contoh: kabut dan awan) sedangkan
yang memiliki zat terdispersi padat disebut aerosol padat (contoh: asap
dan debu dalam udara).
- Sol Sistem koloid dari partikel padat yang terdispersi dalam zat cair. (Contoh: Air sungai, sol sabun, sol detergen dan tinta).
- Emulsi
Sistem koloid dari zat cair yang terdispersi dalam zat cair lain, namun
kedua zat cair itu tidak saling melarutkan. (Contoh: santan, susu,
mayonaise, dan minyak ikan).
- Buih
Sistem Koloid dari gas yang terdispersi dalam zat cair. (Contoh: pada
pengolahan bijih logam, alat pemadam kebakaran, kosmetik dan lainnya).
- Gel sistem koloid kaku atau setengah padat dan setengah cair. (Contoh: agar-agar, Lem).
Sifat-sifat Koloid
Efek Tyndall ialah gejala penghamburan berkas sinar (cahaya)
oleh partikel-partikel koloid. Hal ini disebabkan karena ukuran molekul
koloid yang cukup besar. Efek tyndall ini ditemukan oleh
John Tyndall (1820-1893), seorang ahli fisika Inggris. Oleh karena itu sifat itu disebut efek tyndall.
Efek tyndall adalah efek yang terjadi jika suatu larutan terkena
sinar. Pada saat larutan sejati disinari dengan cahaya, maka larutan
tersebut tidak akan menghamburkan cahaya, sedangkan pada sistem koloid,
cahaya akan dihamburkan. hal itu terjadi karena partikel-partikel koloid
mempunyai partikel-partikel yang relatif besar untuk dapat
menghamburkan sinar tersebut. Sebaliknya, pada larutan sejati,
partikel-partikelnya relatif kecil sehingga hamburan yang terjadi hanya
sedikit dan sangat sulit diamati.
Gerak Brown ialah gerakan partikel-partikel koloid yang
senantiasa bergerak lurus tapi tidak menentu (gerak acak/tidak
beraturan). Jika kita amati koloid dibawah mikroskop ultra, maka kita
akan melihat bahwa partikel-partikel tersebut akan bergerak membentuk
zigzag. Pergerakan zigzag ini dinamakan gerak Brown. Partikel-partikel
suatu zat senantiasa bergerak. Gerakan tersebut dapat bersifat acak
seperti pada zat cair dan gas( dinamakan gerak brown), sedangkan pada
zat padat hanya
beroszillasi di tempat ( tidak termasuk gerak
brown ). Untuk koloid dengan medium pendispersi zat cair atau gas,
pergerakan partikel-partikel akan menghasilkan tumbukan dengan
partikel-partikel koloid itu sendiri. Tumbukan tersebut berlangsung dari
segala arah. Oleh karena ukuran partikel cukup kecil, maka tumbukan
yang terjadi cenderung tidak seimbang. Sehingga terdapat suatu resultan
tumbukan yang menyebabkan perubahan arah gerak partikel sehingga terjadi
gerak zigzag atau gerak Brown.
Semakin kecil ukuran partikel koloid, semakin cepat gerak Brown yang
terjadi. Demikian pula, semakin besar ukuran partikel koloid, semakin
lambat gerak Brown yang terjadi. Hal ini menjelaskan mengapa gerak Brown
sulit diamati dalam larutan dan tidak ditemukan dalam campuran
heterogen zat cair dengan zat padat (suspensi). Gerak Brown juga
dipengaruhi oleh suhu.
Semakin tinggi suhu sistem koloid, maka
semakin besar energi kinetik yang dimiliki partikel-partikel medium
pendispersinya. Akibatnya, gerak Brown dari partikel-partikel fase
terdispersinya semakin cepat. Demikian pula sebaliknya, semakin rendah
suhu sistem koloid, maka gerak Brown semakin lambat.
Adsorpsi ialah peristiwa penyerapan partikel atau ion atau
senyawa lain pada permukaan partikel koloid yang disebabkan oleh luasnya
permukaan partikel. (Catatan : Adsorpsi harus dibedakan dengan absorpsi
yang artinya penyerapan yang terjadi di dalam suatu partikel). Contoh :
(i) Koloid Fe(OH)
3 bermuatan positif karena permukaannya menyerap ion H+. (ii) Koloid As
2S
3 bermuatan negatif karena permukaannya menyerap ion S2.
Dikenal dua macam koloid, yaitu koloid bermuatan positif dan koloid bermuatan negatif.
Koagulasi adalah penggumpalan partikel koloid dan membentuk endapan.
Dengan terjadinya koagulasi, berarti zat terdispersi tidak lagi
membentuk koloid. Koagulasi dapat terjadi secara fisik seperti
pemanasan, pendinginan dan pengadukan atau secara kimia seperti
penambahan elektrolit, pencampuran koloid yang berbeda muatan.
Koloid pelindung ialah koloid yang mempunyai sifat dapat melindungi koloid lain dari proses koagulasi.
Dialisis ialah pemisahan koloid dari ion-ion pengganggu dengan cara
ini disebut proses dialisis. Yaitu dengan mengalirkan cairan yang
tercampur dengan koloid melalui membran semi permeable yang berfungsi
sebagai penyaring. Membran semi permeable ini dapat dilewati cairan
tetapi tidak dapat dilewati koloid, sehingga koloid dan cairan akan
berpisah.
Elektroferesis ialah peristiwa pemisahan partikel koloid yang bermuatan dengan menggunakan arus listrik.
Sumber : http://jalantahes.wordpress.com













 Sumber : facebook.com
Sumber : facebook.com